| Biologie | Chimie | Informatique |
| Math | NTIC | Physique |
|
|||||
| Communauté | |
| Cours | |
| Emploi | |
| Logement | |
| Universités | |
| Réforme "LMD" | |
| Services | |
| Jeux | |
| Info | |
| Météo | |
| Plus | |
| Accueil | |
| Liens |
Le site n'est plus mis a jour actuellement...
© SNOCLUB.fr.st
C Koi ?
La thermodynamique, c’est transformer de la chaleur
en mécanique…
¿QUE PASA DANS UN GAZ ?
Vocabulaire :
Système : ensemble de corps dans un volume fixé de l’espace :
(ex : du gaz dans un cylindre).
Equation d’état : pour gaz parfaits,
équation fondamentale, voir juste après. (pV=nRT)
Une
équation qui tue (si tu la sait pas, t’es mort)
Pour un gaz parfait en équilibre thermodynamique :
Equation d’état :
![]()
p la pression en pascal, V le volume en mètre cube,
n en mol, T en Kelvin (°+273),
R constante des gaz parfaits (8.31441 J/K)
Energie interne d’un gaz :
L’énergie interne dépend uniquement des énergies cinétique
dedans, pour toutes les molécules. On peut donc écrire :
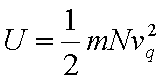
U l’énergie interne, m la masse d’une molécule, N le
nombre d’Avogadro, v vitesse moyenne (quadratique,
d’ou q)
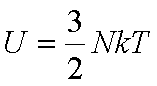
k constante de boltzmann 1,38 . 10-23 J-1.K ;
N Avogadro, T température (kelvin, le degré est mort ! ! « Fred !
il fait 288 Kelvin dehors, met ton pull ! »)
Type : il est pratique, au lieu
de faire chier avec k et R de savoir que Mk=mR, tout dépend si traite
en masse molaire ou moléculaire, et pour passer de l’un à l’autre, use
Avogadro : M=Nm et R=Nk .
L’energie
interne d’un gaz ne dépend QUE de sa température….
Notion
de pression :
La pression, c’est une force par unité de surface (n.m²),
elle s’exprime en pascal. Si tu coures vers une vitre et te ratatine de
front dessus, tu exerces une force F dessus répartie sur toute la surface
de contact, il vaut donc mieux foncer avec la même force F, le coude en
avant… (vandale ! !).
La pression dans un gaz est fonction de l’altitude,
plus tu montes, moins il y en a.
On a donc l’équation fondamentale de la statique des
fluides, pression dans un gaz :
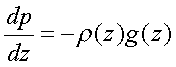
type : pourquoi faire simple quand
on peut faire compliqué ? (‘sont fous ces physiciens !)
Mélange
de gaz parfaits :
Dans le même volume, le nombre de moles, c’est la somme,
les pressions aussi, c’est la somme…. Et le mélange est un gaz parfait.
1e
principe de la thermodynamique :
L’équation
vitale :
Ben oui, la thermo, c’est échanger de la chaleur contre
du travail ou vice versa…
![]()
ça, c’est toujours vrai pour un gaz parfait (donc ceux
que l’on fait exclusivement).
Type : n’oublions pas que l’énergie interne ne
dépend que de la chaleur, donc la variation de cette dernière n’a lieu
que si la température change.
Types
de transformation :
Isotherme : la température ne change pas, donc delta U=0 et W= -Q
Isochore : le volume ne change pas, donc W=0, donc delta U= Q
Isobare : la pression ne change pas
Expression
de tout ce bordel (pour pouvoir retrouver l’inconnu, arf ! )
Ces relations existent pour un état stable, ou dans
le cas d’une évolution quasi statique (succession d’états stables).
![]()
Mathématiquement, on voit que si la transformation
est isochore, il n’y a pas de travail.
Cv : constante de volume (quand la transformation
est isochore)
· Monoatomique :
g = 5/3
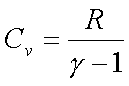
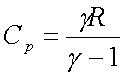
De la, on peut continuer les expressions :
![]()
Le C est à remplacer par Cv ou Cp selon si la transformation
est isochore ou isobare…
Et si c’est isotherme ou adiabatique ?
· Isotherme :
Q = - W
La variation d’énergie interne d’un gaz par une transformation
est de la même expression pour tous les types
de transformation :
![]()
Loi
de Laplace :
Dans une transformation adiabatique de l’état 1 à l’état
2 (quasi statique, gaz parfait comme on fait toujours), on a :
![]()
Représentation
sur le diagramme de Clapeyron :
Diagramme de P en fonction de V
Le travail total échangé dans un cycle :
2e
principe de la thermodynamique :
L’entropie est notée S :
On a toujours ![]() ,
0 pour le cas des transformations réversibles.
,
0 pour le cas des transformations réversibles.
Parlons de la variation d’entropie dans le cas réversible :
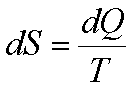
La variation d’entropie entre 1 et 2, c’est l’intégrale
de 1 a 2 de l’expression la haut
Représentation
sur le diagramme entropique :
T en fonction de S.
Cycle : Si trigo, Q<0 else Q>0 (exemple
sur l’isochore, si la température descend, la chaleur se barre…)
Si transformation réversible, alors W(cycle)=-Q(cycle)
(ben, oui, la temp revient, donc U(cycle)=0
Si transformation irréversible, on met des croix a
la place de la ligne
Machines
thermiques :
Moteur : include chaleur, exclude travail
Monotherme : moteur protégé par un thermostat.
(un thermostat ne travaille pas, il fournit de la chaleur, ou en enlève)
=> pas de variation de température => U=0
Ditherme : 2
thermostats différents, donc 2 températures différentes, ici la travail
peut exister.
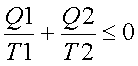 ,
il y a une sortie de chaleur de même ordre que l’entrée.
,
il y a une sortie de chaleur de même ordre que l’entrée.
diagramme de Raveau : Q1 de source chaude en ordonnée,
Q2 en abscisse.
Type : on trace la droite définie par Q2 en fonction de Q1 (t1 et t2 donnés et constants), tout ce qui est a droite est impossible
Le rendement théorique de Carnot ![]() ,
pratiquement, il est toujours plus petit…
,
pratiquement, il est toujours plus petit…
(rapport gain dépense de chaleur, puis
voir Clausius)
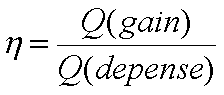
Source : www.fvirtman.fr.st
– Auteur : Fman
ÓSNOCLUB.fr.st